therunofsummer
Оглавление:
- Что такое гибридный замкнутый контур?
- Минимальная спецификация продукции 670G
- Доступность и стоимость
- «Момент водораздела … Трансформация заботы о диабете»
- FDA одобряет Libre Pro
- Отказ от ответственности
Вау, какой огромный момент для сообщества диабета!
В среду FDA одобрила Medtronic Minimed 670G, первую в мире «гибридную систему с замкнутым контуром», которая может автоматически контролировать уровень глюкозы и корректировать дозы базального инсулина у людей в возрасте 14 лет и старше с диабетом типа 1.

Пока мы в сообществе диабета осознаем, что это не полностью закрытая точка доступа, которая полностью контролирует контроль над диабетом, и сама Medtronic осторожно относится к ней как к «гибриду», новому Minimed 670G представляет собой огромный шаг вперед в автоматизации нашего управления болезнями. Woot!
Вот официальное письмо от FDA в Medtronic об этом разрешении, а также пресс-релиз FDA.
Примечательно, что это нормативное утверждение составляет всего 104 дня (!) После того, как Medtronic представила тысячи страниц документов, что на семь месяцев раньше ожидаемого, и это утверждение охватывает более десяти лет исследований, и разработки продукта в достижении этой вехи.
«Это феноменально, и я так взволнован! - говорит Аарон Ковальский, главный офицер миссии JDRF и давний тип 1. «Удивительно быть на этом уровне. Подумайте об этом - это первый раз, когда одна из этих (автоматизированных систем) была одобрена … и короткое время, которое потребовалось FDA, чтобы это устранить ».
Итак, что это новая система контроля глюкозы и как она работает?
Что такое гибридный замкнутый контур?
Термин «гибрид» в этом случае означает, что система частично автоматизирована, но требует определенного контроля со стороны пользователя.
Способ, которым он функционирует, заключается в том, что датчик CGM считывает данные о глюкозе каждые пять минут, а алгоритм замкнутого цикла, встроенный в насос, использует эту информацию для увеличения или уменьшения базального инсулина, чтобы поддерживать уровень глюкозы как можно ближе к цели 120 мг / дл. Пользователям по-прежнему необходимо вводить количество углеводов и количество болюсов для приема пищи, а также предупреждать систему заранее о любых упражнениях, а также не давать автоматические коррекционные болюсы на основе CGM, но она предлагает корректирующие суммы, когда результат пальца введенный так же, как и все стандартные инсулиновые помпы теперь через функцию «Болюс».
< ! --1 ->Эта страница FDA делает хорошую работу, объясняя детали. Система MiniMed 670G имеет два режима, еще один «автопилот», чем другой, но оба требуют вмешательства пользователя (таким образом, это не полностью замкнутый контур):
Ручной режим - в котором система может быть запрограммирована пользователя для доставки базального инсулина с заранее запрограммированной постоянной скоростью.Система автоматически приостанавливает доставку инсулина, если значение глюкозы в датчике падает ниже или, как предполагается, падает ниже заданного порога. Система также автоматически возобновит доставку инсулина, как только уровень глюкозы в датчике повысится выше или, как ожидается, повысится выше заданного порога.
Автоматический режим - система может автоматически регулировать базальный инсулин путем непрерывного увеличения, уменьшения или приостановки доставки инсулина на основе значений CGM (в отличие от ручного режима, при котором базальный инсулин поставляется с постоянной ставка). Хотя автоматический режим может автоматически регулировать базовую доставку инсулина без ввода от пользователя, пользователь должен по-прежнему вручную доставлять инсулин во время еды.
Это новый тип устройств, который никогда не видел на рынке - и тот факт, что он одобрен здесь в США, прежде чем попасть на европейский и международный рынки, вряд ли можно переоценить.
Минимальная спецификация продукции 670G
Внешне Minimed 670G выглядит и чувствует себя почти идентично недавно одобренному компанией Minimed 630G, который привносит новую вертикальную ориентацию и цветной экран в стандартную конструкцию насоса Medtronic.

Большая разница заключается в том, что эта инсулиновая помпа-CGM-комбо контролируется сложным алгоритмом, который Medtronic использует в своей технологии SmartGuard Hybrid Closed Loop, которая может автоматически регулировать базовый инсулин и автоматическое отключение при необходимости. Специфические особенности продукта:
- Блок насоса: Как уже отмечалось, внешний вид такой же, как и Minimed 630G, введенный только в прошлом месяце (уже устаревший?). Одна и та же батарея АА, такие же инфузионные наборы и 300-дюймовый резервуар для инсулина, и немного больше, чем традиционно разработанные мини-насосы с горизонтальной ориентацией. В отличие от старых насосов Medtronic, это устройство предлагается только в черном цвете, но при желании вы можете купить несколько разных шкурок, чтобы придать им внешний вид.
- Кнопки и меню: Единственными незначительными отличиями между 630G и новым MiniMed 670G являются тот факт, что верхняя правая кнопка приводит вас непосредственно к графикам CGM по сравнению с дорожкой к меню, а само меню немного отличается , учитывая новые варианты режимов и т. д., в новой системе.
- Цветной экран: Как и у 630G, новая система также оснащена ярким полноцветным экраном (!), Который автоматически настраивается на ситуации освещения, так что ночью он не загорается так ярко, как может в течение дня. Это, по-видимому, намного легче читать, что является большой выгодой для людей с нарушениями зрения, конечно. Наряду с базовыми данными насоса и CGM на рабочем столе отображается информация о инсулине на борту (IOB) - что-то требуют пользователи.
- Технология CGM: В новой системе используется датчик CGM четвертого поколения Medtronic, который был назван Enlite 3, но теперь будет известен как датчик Guardian 3 ( мы имеем краткое изложение все различные условия Medtronic на Storify ). Он очищается FDA для ношения на теле в течение 7 дней, по сравнению с 6 днями для предыдущих поколений.Тем не менее, ничего нового на клеевом фронте.

- Повышенная точность: Guardian 3 более надежный и точный, сообщает Medtronic, потому что он использует новый радиосигнал (введенный с 630G) для связи между передатчиком и датчиком. Согласно данным клинических аналитических исследований компании при двух калибрациях в день, частота ошибок MARD в среднем составляет 10,25%, что не так хорошо, как последний Dexcom G5 на 9%, но намного лучше, чем на 14% текущий Enlite может предложить - так что это потенциальный игровой чейнджер, чтобы сделать Medtronic более сильным конкурентом на рынке CGM!
- Ваш режим может варьироваться: Medtronic говорит, что он слушал людей о желании выбора, поэтому он позволяет переключаться между режимами: автоматический режим для гибридной функции замкнутого контура или ручной режим, который все еще предлагает функцию Suspend on Low для когда вы пересекаете этот порог гипо (как у 530G и 630G), так и Suspend Before Low, который может быть установлен для прогнозирования гипоса за 30 минут до их возникновения (как в международном доступном 640G).

- Настройка BG Target: Эта технология предназначена для «лечения цели», что означает, что она позволяет максимально приблизить уровни BG до 120 мг / дл. К сожалению, это не может быть изменено … что означает, что Medtronic принимает только «персонализацию и настройку». Пользователь может установить временную цель в 150 мг / дл на срок до 12 часов, чтобы справляться с ситуациями, например, упражнения, но это единственная гибкость. В Medtronic говорится, что это было результатом попытки сначала выйти на рынок, потому что разрешение различных целей означают гораздо более крупные клинические испытания, которые задерживали бы утверждение регулирующих органов и коммерциализацию. Будущие поколения, вероятно, позволят варьировать целевые уровни, сообщает Medtronic.
- Отсутствие обмена данными: Как и предыдущая система Minimed 630G, этот гибридный замкнутый контур 670G не имеет встроенного Bluetooth и не будет работать с Minimed Connect для обмена данными с мобильными телефонами ( ?!). Для тех, кто хочет обмена данными, Medtronic указывает людям на свою систему Minimed 530G, которой сейчас более трех лет. В результате этого отсутствия возможности подключения 670G не будет работать ни с одним из разработчиков мобильных приложений IBM Watson или мобильных приложений.
- Подключенный счетчик BG: Система настроена на непосредственную связь с Bayer Contour Link 2. 4 Meter, который Ascensia представил с объявлением о запуске 630G. Это позволяет удалять болюсы с измерителя, но только в ручном режиме, а не в автоматическом режиме с замкнутым контуром.
- Две калибрации Daily: Система требует по крайней мере одной калибровки пальца каждые 12 часов, и если ее не ввести, она автоматически выталкивает пользователя из автоматического режима.
- Сертифицирован одним нажатием: В 670G используется новый одноразовый пресс Medtronic, который, по его словам, облегчит и упростит вставку датчика. Для этого требуется всего одно нажатие кнопки, по сравнению с предыдущим поколением, которое было более громоздким, и потребовалось два нажатия кнопок (один раз для вставки и один раз для втягивания).
- Дети и подростки: Minimed 670G официально обозначен в возрасте от 14 лет и старше, но компания говорит, что он уже проводит испытания для одобрения у детей в возрасте от 7 до 13 лет, а также технико-экономические обоснования для тех, кто еще 2 года. В текущем письме об утверждении FDA указано, что 670G не следует использовать в возрасте до 7 лет, а также у тех, кто потребляет менее 8 единиц инсулина в день (поскольку устройство требует, чтобы минимум в день работал безопасно). Metronic говорит, что у него недостаточно данных у тех, кто принимает менее 8 единиц в день, чтобы узнать, эффективен ли этот алгоритм и безопасен ли он.
Доступность и стоимость
Благодаря гораздо более быстрому, чем ожидалось, нормативному утверждению, Medtronic сообщает нам, что им нужно как минимум шесть месяцев для подготовки к запуску американского продукта, начиная с весны 2017 года. Для тех, кто находится за пределами штата, Medtronic говорит ожидать одобрения регулирующих органов в середине 2017 года.
Есть много «движущихся частей», которые должны быть установлены на месте здесь, в Америке, объясняют они, плюс они в настоящее время находятся в середине запуска Minimed 630G; что предыдущая модель совсем недавно начала поставляться пациентам в США.
Да, будет путь обновления для всех, кто использует текущие продукты Medtronic - называется программой приоритетного доступа. На самом деле, это побуждает клиентов начинать работу с Minimed 630G в ближайшие месяцы до того, как 670G выйдет на рынок, рекламируя, что такой переход поможет пациентам тренироваться на новой платформе и потенциально снизить их издержки на карманные расходы до 0 долларов.
- Первоначальная стоимость программы приоритетного доступа = $ 799
- Кредит за кредит на MiniMed 630G pump & CGM system = $ 500
- Общая стоимость карманных программ = всего $ 299
- Участие в опросах и других программах обратной связи с пользователями может также уменьшают эту стоимость, как минимум до $ 0 для некоторых людей, говорится в сообщении компании
Программа приоритетного доступа проходит до 28 апреля 2017. Medtronic также говорит, что больше предложений и возможностей обновления могут быть обнаружены ближе к времени запуска весной.
Конечно, Medtronic также будет работать в ближайшие месяцы с плательщиками и страховыми компаниями на покрытие этой технологии. Со всеми недавними спорами по этим вопросам (#DiabetesAccessMatters) мы надеемся, что Medtronic помнит, что, хотя многим пациентам нужна эта система, это может быть не лучший выбор для всех - и выбор вопросов!
«Момент водораздела … Трансформация заботы о диабете»
JDRF выпустила пресс-релиз в среду, в котором выражается волнение об этой знаковой технологии и о том, как быстро движется FDA. Американская ассоциация диабета также подхватила пресс-релиз об этом одобрении, отметив его значимость.
Подумайте об этом: Десять лет назад многие по-прежнему считали, что система с замкнутым циклом - это трубопровод. Но JDRF разработала реальный план перехода к искусственной поджелудочной железе. Это были еще самые первые дни технологии CGM … и посмотрим, как далеко мы пришли!
«Это было невероятно быстро, и это показывает, насколько важна вся тяжелая работа, которую мы делали на стороне политики в тот же день, чтобы создать руководство для этих систем», - сказал Ковальский, который лично сыграли важную роль в обеспечении приоритета технологии AP.«Это изменило все и создало путь, и теперь мы здесь. Это массивный, действительно переломный момент, который может трансформировать лечение диабета!»
Если вы считаете, что Minimed 670G «Искусственная поджелудочная железа» или нет, это почти не имеет значения … Дело в том, что у нас есть устройство, которое закрывает цикл так, как мы раньше не видели, раннее создание AP. Это потенциально изменяющая жизнь технология, которая была доступна в рекордные сроки.

Фактически, FDA одобрило одобрение рынка для этого Minimed 670G, а также потребовало дополнительных исследований после рынка, направленных на лучшее понимание того, как устройство работает в реальных условиях. Это показывает, что FDA готова смотреть на существующие данные и доверять преимуществам, не сдерживая возможности будущих данных.
Путешествие действительно потрясающе, как записано в этом посте D-Mom и давним сторонником JDRF Мойрой Маккарти Стэнфорд, о том, как организация проложила путь к этой вехе и за ее пределами.
Мы также поговорили с Джеффри Брюэром, который возглавляет Bigfoot Biomedical, который разрабатывает свою собственную систему замкнутого цикла, которая, как ожидается, будет доступна в 2018 году. Наряду с Аароном Ковальски, Брюер считается одним из «Отцов AP», учитывая их роль в содействии разработке и продвижению замкнутого цикла в JDRF.
«Мы рады, что FDA движется быстрее и более поддерживает автоматизированные системы доставки инсулина, и мы стараемся помочь тем же ветрам!» Пивовар сказал нам.
Без сомнения, это переместит иглу вперед на более чем 18 других замкнутых систем в работах - особенно тех, которые используют только инсулин. Некоторые добавляют дополнительный гормон глюкагон в смесь для борьбы с гипогликемией (например, Beta Bionics iLET и Pancreum Genesis), что может потребовать больше времени оценки FDA.
Мы рады услышать, что наши друзья в сообществе «Сделай сам» #OpenAPS также в восторге от этого новейшего утверждения, и что это значит для всех нас.
Приятно видеть, что FDA так быстро продвигается не только на этом одобрении Minimed 670G, но и на других интересных технологиях и данных о развитии технологий в последние годы. Ясно, что FDA признает движение #WeAreNotWaiting и делает все возможное, чтобы идти в ногу с этими быстро развивающимися временами.
FDA одобряет Libre Pro
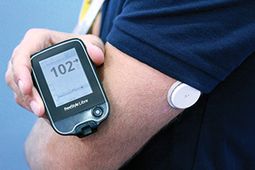
Это не потребительское устройство, но версия клиники Abbott's новой технологии мониторинга флюоресценции (FGM), которая уже доступна пациентам за рубежом.
Также упоминается как «гибридная» система, но только для мониторинга глюкозы. Abbott Libre состоит из небольшого круглого датчика, который надевается на 14 дней на задней части плеча, и контроллера, который просто прокручивает над ним столько раз в день, сколько необходимо или желательно принимать беспроводные показания глюкозы.
Он не предлагает никаких предупреждений о повышении или понижении уровня глюкозы, а в потребительской версии за рубежом хранится всего 8 часов данных.Цель состоит в том, чтобы создать более простое решение для мониторинга, которое также могло бы помочь многим типам 2 быть более в контакте со своими уровнями глюкозы в реальном времени.
Хотя это не традиционная CGM, как мы ее знаем, Эбботт говорит, что нормативные правила классифицируют Libre как CGM. И то, что они одобрили сейчас, является версией, разработанной специально для врачей, чтобы предоставлять своим пациентам краткосрочное использование, и она предоставляет только ослепленные данные для просмотра врачами. Это первый шаг к потребительской версии, которую Abbott также недавно подала на утверждение FDA здесь, в Штатах.
Будем надеяться, что это произойдет в ближайшее время, с ускоренным ускорением инноваций FDA.
Огромная благодарность всем, кто участвовал - не в последнюю очередь - в FDA - для продвижения этих важных инструментов по уходу за диабетом во всех наших интересах!
Отказ от ответственности : Содержание, созданное командой диабета. Чтобы узнать подробности, нажмите здесь.Отказ от ответственности
Этот контент создан для Diabetes Mine, блог о здоровье потребителей, посвященный сообществу диабета. Содержание не проверяется с медицинской точки зрения и не соответствует редакционным рекомендациям Healthline. Для получения дополнительной информации о партнерстве Healthline с диабетической шахтой, пожалуйста, нажмите здесь.
Нехирургический контур тела: как подготовиться, процедура и стоимость

Bigfoot создает самодельный замкнутый контур диабета

В этом гостевом посте DiabetesMine, семья за Bigfoot Biomedical рассказывает свою историю о взломе домашней искусственной поджелудочной железы.
Диабет Обзор продукта: гибридный замкнутый контур Medtronic 670G

DiMeMine рассматривает новый гибридный замкнутый контур Minimed 670G от Medtronic Diabetes - системы первого поколения технологии искусственной поджелудочной железы.




